Quel impact sur la qualité d’un sol?
La première partie de cette synthèse technique a été rédigée grâce aux travaux bibliographiques de M. Jeremy Jean-Guy Cottes réalisés dans le cadre de son mémoire de thèse intitulé « Le couple Eh/pH du sol : sa mesure, son impact sur la mobilité des nutriments et la croissance du tournesol » (Sciences de la Terre, INPT, 2019).
Lire la thèse complète de M. Jeremy Jean-Guy Cottes
1. Les minéraux, nutriments indispensables à la croissance des plantes
Directement impliqués dans le processus de photosynthèse, trois éléments composent 90 à 96% de la matière sèche des plantes, ce sont le carbone, l’oxygène et l’hydrogène. Les autres éléments sont des minéraux que les plantes absorbent par l’intermédiaire des racines en même temps que l’eau (Schvartz et al. 2005). Ces éléments minéraux, indispensables à la croissance des végétaux, sont divisés en deux groupes :
- Les macro-éléments sont les nutriments dont les plantes ont besoin en plus grandes quantités. Leurs teneurs dépassent 0,01% de la Matière Sèche (MS) des végétaux cultivés. Il s’agit de l’azote (N), du phosphore (P), du potassium (K), du magnésium (Mg), du soufre (S) et du calcium (Ca).
- Les oligo-éléments sont les micronutriments dont la plante n’a besoin qu'en petites quantités. Ils sont souvent nécessaires en tant que cofacteurs de l'activité enzymatique. Ils sont présents à moins de 0,01% dans la Matière Sèche (MS) des végétaux cultivés. Ce groupe comprend principalement le fer (Fe), le manganèse (Mn), le zinc (Zn), le cuivre (Cu), le bore (B), et le molybdène (Mo).
Figure 1 : Physiologie de la plante (Feller et al. 2016)
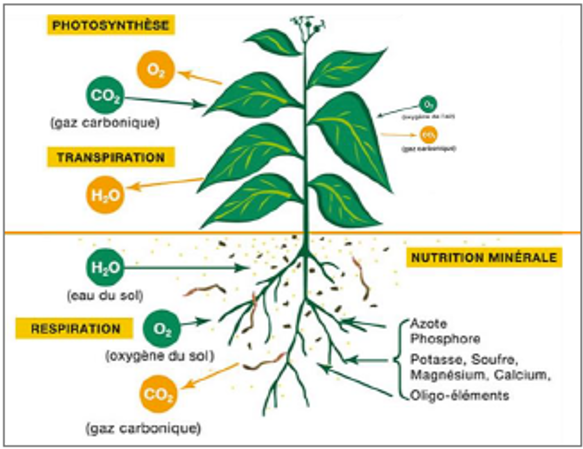
De nombreux facteurs interviennent dans la mise à disposition pour les cultures des nutriments présents dans le sol. Le potentiel Hydrogène (pH) et le potentiel d’oxydoréduction (Eh) sont deux variables largement déterminantes de la chimie du sol. Ils déterminent la forme chimique des oligo-éléments et des macro-éléments, donc leurs interactions (précipitations…) et par conséquent leur solubilité, leur mobilité et leur assimilabilité par les plantes.
2. Le potentiel d’oxydoréduction (Eh)
Le potentiel d’oxydoréduction (Eh) concerne l’activité des électrons. Les réactions d'oxydo-réduction (rédox) sont des réactions pour lesquelles un ou plusieurs électrons sont échangés entre les réactifs. Le réactif est appelé « Oxydant » s’il est susceptible de gagner un ou plusieurs électrons et « Réducteur » s’il est susceptible de perdre un ou plusieurs électrons. L'oxygène est l'accepteur d'électrons privilégié des micro-organismes du sol. En conséquence, l’inondation, la compaction ou l’aération des sols, en modifiant la porosité du sol accessible à l’air (AFPS), sont d’importants levier de modification de Eh. L’AFPS est très corrélée avec Eh quand celle-ci est comprise entre 15% et 40%, seuil où l’aération devient insuffisante pour l’activité microbienne aérobie. Le Eh des sols fluctue entre -300 et +900 mV/ENH. Les sols cultivés se situent le plus souvent entre 300 et 500 mV/ENH en conditions aérobies. Les Eh négatifs sont rencontrés dans des conditions anaérobies intenses typiques des sols saturés en eau de manière permanente.
Tableau 1 : Principales classes de Eh de sol (Reddy and DeLaune, 2008)
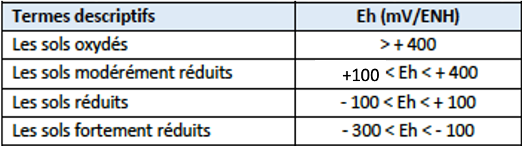
Eh est un facteur majeur du bon fonctionnement cellulaire. Des déséquilibres de ce paramètre peuvent causer des dommages sévères, voire la mort des cellules. Pour la croissance des plantes, les valeurs optimales de Eh sont comprises entre 350 et 450 mV/ENH (Husson 2013). Lorsque le Eh passe en dessous de 350 mV/ENH, la croissance s’atténue fortement en raison d’une baisse des activités de photosynthèse et des activités enzymatiques (Pezeshki 2001; Dwire et al. 2006).
3. Modification du potentiel d’oxydo-réduction
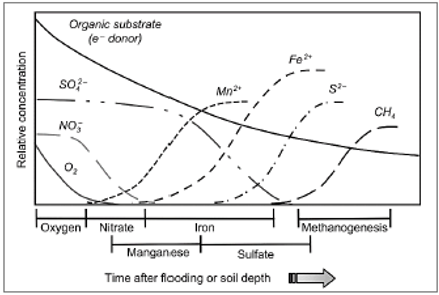
Lors d’une inondation, en fonction des caractéristiques du sol, le Eh diminue plus ou moins rapidement pour tendre vers une valeur comprise entre 0 et -200mV/ENH, caractéristique d’un sol saturé en eau. La plupart des organismes aérobies deviennent alors inactifs ou meurent. Les populations microbiennes adaptées aux environnements anaérobies se développent. Ces micro-organismes utilisent d'autres composés en substitution à l’oxygène comme accepteur d’électrons pour favoriser l'oxydation biologique des substrats organiques dans le cadre de leur respiration. La vitesse à laquelle ces accepteurs d'électrons sont consommés dans le sol dépend de leur concentration, de la présence de composés organiques facilement biodégradables et de la population microbienne impliquée dans les processus de réduction (Reddy and DeLaune 2008).
Figure 2 : Évolution des populations microbiennes du sol après une inondation (Reddy and DeLaune 2008)
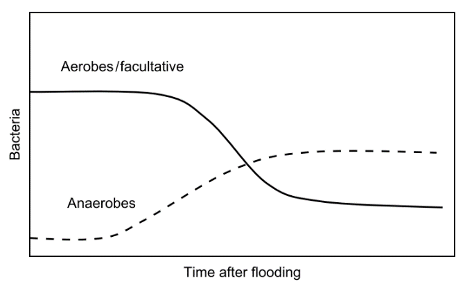
Figure 3 : Différents accepteurs d'électrons en fonction du temps après inondation d'un sol (Reddy and DeLaune 2008)
 `
`
L’azote, le manganèse, le fer et le soufre sont directement impactés par le Eh du sol. Respectivement sous la forme NO3- et SO42-, N et S sont fortement mobiles dans les sols en conditions oxydées. Avec la mise en place de conditions anaérobies, la forme prédominante de N devient NH4+ et celle de S devient S2-, ce qui engendre une plus forte adsorption de N et une perte de S pour la plante. A l’inverse, présents en milieu aérobie sous forme d’oxydes insolubles, la réduction de Fe en Fe2+ et de Mn en Mn2+ améliore la disponibilité de ces deux éléments rendus solubles. Dans certaines situations une trop forte libération de Fe et Mn dans la solution du sol peut engendrer une toxicité chez les plantes.
Tableau 2 : Occurrence des réactions redox en fonction de Eh
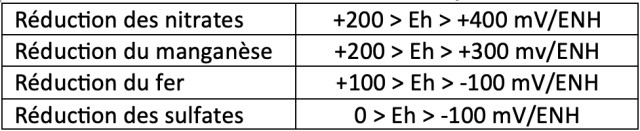
L’oxydation/réduction de N, Mn, Fe et S a des conséquences sur les autres éléments présents dans le sol. La libération de Fe2+ et Mn2+ engendre par exemple une compétition accrue sur les sites d’adsorption du complexe d’échange du sol provoquant ainsi la désorption d’autres cations comme Mg2+ et Ca2+. Le phosphore, précipité ou adsorbé sur les oxydes de fer, est également libéré lors de la réduction du fer. Il en est de même pour le cuivre, le bore et le molybdène.
4. Le potentiel Hydrogène (pH)
Le potentiel Hydrogène (pH) caractérise l’activité des protons. Il influence considérablement de nombreuses réactions et processus chimiques du sol. Il intervient, entre autres, dans la formation des sols, les grands cycles biogéochimiques, la solubilisation des éléments nutritifs et les processus essentiels au fonctionnement énergétique des cellules. La gamme de pH des sols situés entre 6 et 7 est optimale du point de vue de la mobilité des nutriments et donc à la croissance des plantes. Cela est relativement connu des agriculteurs qui maintiennent le pH des sols cultivés à des niveaux proche de la neutralité.
Figure 4 : Termes descriptifs pour différentes plages de pH du sol (Sparks 2003)
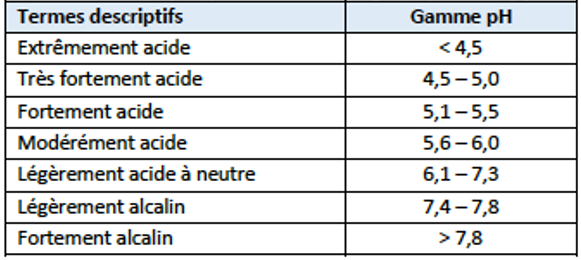
Figure 5 : Effet du pH sur la disponibilité des nutriments importants pour la croissance des plantes. À mesure que la bande pour un nutriment particulier s'élargit, la disponibilité du nutriment est plus grande (Sparks 2003)
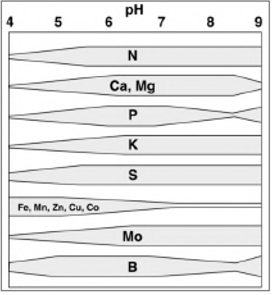
En dessous de pH 6, Fe, Mn, Cu et Zn sont facilement solubles, leur mobilité est accrue. C’est aussi le cas d’autres métaux comme l’aluminium, le cadmium, le plomb, le chrome… Le milieu peut devenir toxiques pour les plantes. En dessous de pH 5,5 ces ions métalliques peuvent réagir avec les phosphates pour donner des phosphates de fer ou d’aluminium, entraînant une diminution de la disponibilité du phosphore. Ce processus diminue aussi la biodisponibilité des sulfates, molybdates, borates et nitrates.
Lorsque le pH dépasse la valeur de 7, les éléments métalliques se trouvent sous des formes peu solubles et génèrent des carences. La chlorose ferrique est fréquente sur les sols calcaires. L’abondance du calcaire actif fait également évoluer les phosphates vers des formes de phosphates de calcium peu solubles.
5. L’azote
Figure 6 : Le cycle simplifié de l'azote
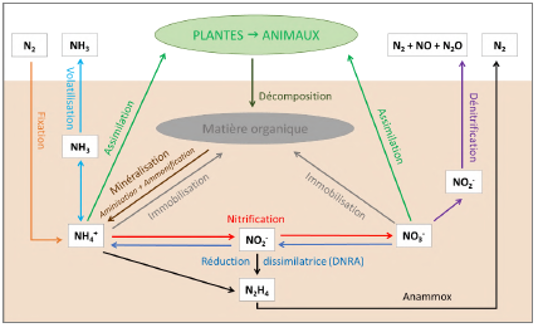
L’azote est un des macro-éléments essentiel au bon fonctionnement des plantes. C’est l'élément nutritif le plus impactant sur les rendements des cultures (Marschner 1995). Le nitrate (NO3-) et l’ammonium (NH4+) sont les deux formes d’azote disponibles pour les plantes et les microorganismes. Les nitrites (NO2) sont présents dans les sols en moindres quantités et sont toxiques pour les plantes. Les différentes formes d’azote subissent des transformations au sein du cycle de l'azote : fixation, assimilation par les plantes, minéralisation, nitrification, lixiviation, volatilisation, dénitrification... L’ensemble de ces processus sont très dépendants de l’activité biologique des sols. Tout au long de ces transformations, le degré d’oxydation de l’azote varie, ce qui en fait un élément très sensible au potentiel d’oxydo-réduction des sols (Reddy and DeLaune 2008).
Figure 7 : L’oxydoréduction de l’azote. (a) Les réactions redox de l'azote (Reddy and DeLaune 2008). (b) Diagramme de Pourbaix de l'azote représentant les différentes formes de N dans une solution de 100 μM à 25°C (Husson 2013)
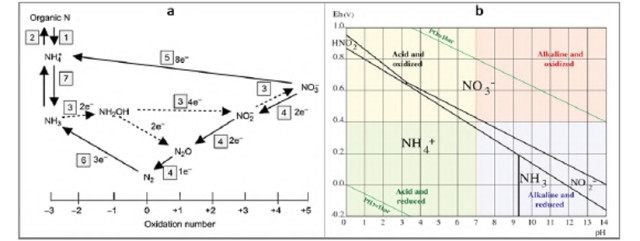
1 = ammonification, 2 = immobilisation, 3 = nitrification, 4 = dénitrification, 5 = réduction dissimilatrice du nitrate en ammonium (DNRA), 6 = fixation de l'azote, 7 = volatilisation de l'ammoniac
Une plus forte rétention de l’azote peut avoir des effets positifs ou négatifs selon les plantes et leurs architectures racinaires. Lorsque la plante développe sans contrainte son système racinaire en exploitant l’espace poral, elle peut accéder au NH4+ retenu dans le sol, qui constitue un réservoir relativement abondant d’azote. En revanche, lorsque les systèmes racinaires sont contraints, les plantes puisent essentiellement l’azote dans la solution du sol, qui s’avère déficitaire. La forme d'azote assimilée par les plantes (NH4+ ou NO3-) a en retour un effet marqué sur le pH rhizosphérique et sur l'assimilation d'autres cations et anions. Les variations de teneurs en NH4+ a par exemple un impact sur la sorption d’autres cations, comme le potassium.
6. Phosphore
Le phosphore est un nutriment essentiel pour les animaux, les plantes et donc pour le rendement des cultures. Il joue un rôle essentiel dans le développement cellulaire et est un composant clé des molécules telles que l'ATP, l'ADN et les lipides (Plassard et al. 2015). Dans les sols des régions tempérées, le phosphate (PO43-) est la forme de phosphore la plus abondante (Scheiner 2005). Or les réactions avec les phosphates n'impliquent pas de transfert d'électrons. Le potentiel d'oxydo-réduction a cependant un effet indirect sur la solubilité du phosphore de par son affinité avec l’aluminium dans les sols fortement acides, le fer dans les sols acides et le calcium dans les sols alcalins, eux-mêmes dépendant du potentiel rédox.
Les quantités biodisponibles de phosphore dans le sol sont généralement faibles au regard des quantités totales. Fortement retenu, le phosphore est peu mobile et en faible concentration dans la solution du sol avec moins de 1% du phosphore total (Hinsinger 2001). Afin de pallier au manque de phosphore disponible les plantes vont mettre en place divers procédés dont notamment la sécrétion d’exsudats au niveau des poils racinaires (Plassard et al. 2015). Ces exsudats rendent une partie du phosphore immobilisé en phosphore disponible au prix d’une dépense énergétique importante pour la plante (Husson 2013).
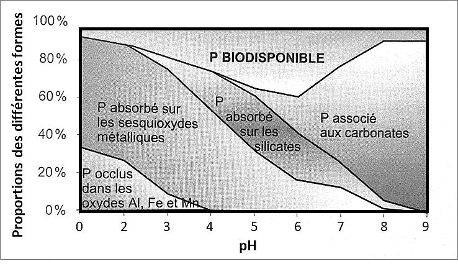
Figure 8 : Répartitions des différents états du phosphore en fonction du pH du sol (Sharpley et Moyer, 2000)
7. Fer
Le fer est un oligo-élément pour les organismes vivants et un élément majeur en géoscience. Quatrième élément en poids de l'écorce terrestre après l'oxygène, le silicium et l'aluminium, il est très largement l'oligo-élément le plus abondant dans les sols. Son abondance et sa sensibilité aux variations rédox en font un indicateur utilisé pour l’identification de conditions anaérobies temporaires (sols rédoxiques) ou permanentes (sols réductiques).
Malgré son abondance, le fer est souvent limitant pour la croissance des plantes à cause de sa tendance à former des complexes insolubles dans les conditions aérobies à pH neutre à basique (Guerinot and Yi 1994). La forme majoritaire est donc la forme ferrique Fe3+, insoluble dans la gamme des pH des sols. La forme réduite et soluble Fe2+, se rencontre surtout dans les sols saturés en condition anaérobie. La réduction du fer a d’importantes conséquences sur le reste de la chimie du sol (Ponnamperuma, 1972). Les principales sont :
- Élever le pH par la consommation de protons lors de la réduction du fer ;
- Accroitre la compétition sur les sites d’adsorption du complexe d’échange du sol et provoquer la désorption des autres cations comme Mg2+ et Ca2+ ;
- Augmenter la solubilité du phosphore, du cuivre et du molybdène.
8. Relation entre pH, Eh, plantes et microorganismes
Figure 9 : Eh/pH caractéristiques des sols (Sparks 2003)
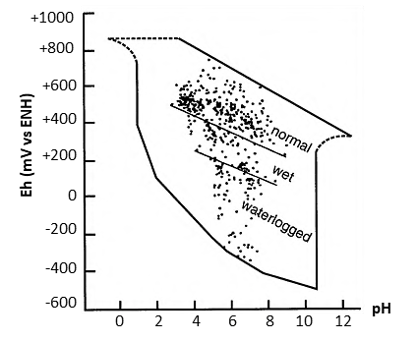
Il existe une corrélation négative entre le pH et le Eh des sols. En effet, il est fréquent que les réactions impliquent à la fois un transfert d’électrons et de protons. Les plantes fonctionnent donc au sein d’une gamme Eh/pH bien spécifique. Elles ont même la capacité de modifier ces paramètres dans la rhizosphère pour assurer l’homéostasie intracellulaire. La modification du couple Eh/pH peut alors être réalisée soit directement via les exsudats racinaires, soit indirectement via la sélection spécifique de microorganismes (Hinsinger et al. 2009). La sécrétion d’exsudats racinaires représente néanmoins un coût énergétique important pour la plante. Plus le couple Eh/pH du milieu sera éloigné des conditions optimales et plus le coût énergétique sera important (Neumann and Römheld 2007; Gobat et al. 2010). Les microorganismes modifient également le Eh et pH de leur environnement selon leurs besoins. Via leur sélection, ils contribuent ainsi à améliorer les conditions du milieu dans lequel se trouve la plante (Rabotnova and Schwartz 1962; Ladha et al. 2003). Il y a donc une co-évolution qui s’installe entre les plantes, les microorganismes et le couple Eh/pH du sol.

